注:本文未经金阁顿授权禁止转载,否则将视为侵权,我们将采取法律措施维护权益。
在新加坡,从事保健品、传统药物或中成药的进口、批发及本地制造等相关经营活动,企业必须依据其经营活动的具体性质,向新加坡卫生科学局(HSA)申请并取得相应类别的药品牌照。
一、新加坡保健品监管概述
1.什么是保健品
保健品是指用于补充膳食,以及支持或维持、增强和改善人体健康功能的产品。它不能是注射剂或需要无菌的制剂,例如滴眼剂。它也不能是餐食或膳食的一部分。
保健品还必须包含以下一种或多种成分,或它们的组合:
a.维生素、矿物质、氨基酸、脂肪酸、酶、益生菌和其他生物活性物质;
b.源自天然来源的物质,包括来自动物、矿物和植物材料的提取物、分离物、浓缩物等形式;以及
c.a和b项中提及成分的合成来源。
保健品必须以单剂量单位或小剂量形式给药,常见剂型包括:
● 胶囊;
● 软胶囊;
● 片剂;
● 液体;
● 糖浆。
用于动物的产品,以及以食品和饮料形式呈现的产品,如饼干、咖啡和果汁,不属于保健品。
食品和具有食品性质的产品属于新加坡食品局(SFA)的管辖范围。

2.对保健品的管控
保健品在进口、制造和销售方面,无需获得新加坡卫生科学局(HSA)的批准或牌照。HSA禁止在保健品中添加类固醇等药用成分。HSA还对这类产品中的有毒重金属设定了严格限制。经销商(进口商、制造商、批发商和销售商)有义务确保其产品无害、安全,并且在供应保健品到新加坡之前符合相关规定。
经销商可自愿向HSA通知其在新加坡供应的保健品。公司必须向HSA提供相关文件,以证明其产品符合必要的安全和质量标准。
(1)安全与质量标准
作为保健品的经销商,您必须确保您的产品符合HSA的安全与质量标准。
①禁止和受限制的成分
进口或销售的保健品不得含有以下成分:
● 根据《毒药法令》(第234章)及其条例、《滥用药物法令》(第185章)及其条例以及《东盟保健品成分负面清单纳入和排除指导原则》(在东盟网站上,点击“关键文件与出版物”下的“政策与指南”展开该部分,并参考第11点)所管控和禁止的成分;
● 源自人体部位的成分;
● 可能影响人体健康的成分(详见《保健品指南》和《建立成分安全性指南》);
● 含有可导致动物传播疾病(如传染性海绵状脑病(TSE))媒介的成分;
● 受《濒危物种(进出口)法令》监管的成分(除非获得许可),需要从国家公园局(NParks)获取《濒危野生动植物种国际贸易公约》(CITES)进口牌照;
● 标签上未声明的活性物质;
● 有文献记载具有固有药理特性,可能导致该物质用于治疗或预防任何疾病或病症的药用目的的活性成分。
一些物质在用于保健品和传统药物时,有可能造成不良健康影响或安全问题,因此应施加特定限制或条件(例如最大日剂量限制或标签规范)后方可使用。
②有毒重金属限值
您的产品不得超过以下重金属限值:
● 砷:5 ppm;
● 镉:0.3 ppm;
● 铅:10 ppm;
● 汞:0.5 ppm。

③微生物限值
您的产品不得超过以下微生物限值:
● 总需氧微生物计数:每克或每毫升不超过10⁵ CFU;
● 酵母和霉菌:每克或每毫升不超过5 x 10² CFU;
● 大肠杆菌、沙门氏菌和金黄色葡萄球菌:不得检出。
尽管有上述限值规定,经销商和销售商有义务确保根据推荐的使用条件和目标用户使用时,产品的微生物含量和重金属是适宜和安全的。鼓励经销商遵守《东盟污染物限值指南》中关于微生物限值的规定。适用的指南发布在东盟网站上(网址:https://asean.org/our-communities/economic-community/standard-and-conformance/;点击“关键文件与出版物”下的“政策与指南”展开该部分,并参考第11点)。
④二甘醇和乙二醇限值
口服液体辅助保健品的二甘醇和乙二醇含量不得超过以下限值(含量(按重量计)):
● 二甘醇:1000 ppm;
● 乙二醇:1000 ppm。
⑤维生素和矿物质限值
维生素限制
以下适用于一般成人人群的保健品中维生素的限值(最大每日限值):
● 生物素:0.9毫克;
● 叶酸:0.9毫克;
● 烟酰胺:450毫克;
● 烟酸:15毫克;
● 维生素A(视黄醇):1.5毫克(5000 IU);
● 维生素B1:100毫克;
● 维生素B2:40毫克;
● 维生素B5(泛酸):200毫克;
● 维生素B6:100毫克;
● 维生素B12:0.6毫克;
● 维生素C:1000毫克;
● 维生素D:0.025毫克(1000 IU);
● 维生素E:536毫克(800 IU);
● 维生素K1/K2:0.12毫克。
矿物质限值
以下规定了适用于一般成人人群的保健品中矿物质的限值(最大每日限值):
● 硼:6.4毫克;
● 钙:1200毫克;
● 铬:0.5毫克;
● 铜:2毫克;
● 碘:0.15毫克;
● 铁:15毫克(对于供孕妇使用的多种维生素和矿物质补充剂,可以考虑更高的铁限值,即30毫克/天。);
● 镁:350毫克;
● 锰:3.5毫克;
● 钼:0.36毫克;
● 磷:800毫克;
● 硒:0.2毫克;
● 锌:15毫克。
保健品中维生素和矿物质的含量若高于为一般成人人群设定的限值,且用于需要更高补充水平的特定成人人群,必须通过以下方式证明其合理性:
● 可信的权威参考文献或专家意见,以证明需要补充高于为一般成人人群设定的限值;
● 医疗专业人员对特定患者额外补充需求的评估和推荐。
用于补充特定疾病患者的产品,其标签上应注明:
● 该产品必须在医疗保健专业人士的建议下使用;
● 非该产品适用病症者使用该产品可能构成健康风险。
为需要更高补充水平的特定成人人群设计的补充剂示例包括:
● 用于伤口或代谢性疾病患者的锌补充剂;
● 用于某些遗传或代谢性疾病患者的维生素B2补充剂;
● 用于孕妇预防神经管缺陷复发或用于叶酸缺乏症患者的叶酸补充剂;
● 用于血红蛋白水平低的患者的铁补充剂。

⑥质量标准
您的产品需要在以下方面达到可接受的质量标准:
● 产品稳定性和保质期;
● 储存条件和分销实践;
● 生产、包装和组装条件。
(2)标签标准
您的产品标签应醒目突出,其英文信息应充分且真实。标签应包含以下内容:
● 产品名称(包括品牌名称,如有);
● 剂型;
● 活性成分名称和含量;
● 产品功效/预期用途;
● 用法用量;
● 批号;
● 有效期;
● 制造国;
● 本地进口商名称和地址(针对海外生产产品)或产品所有者名称和地址(针对本地生产产品);
● 禁忌症(如有);
● 其他警告(如有);
● 储存条件;
● 包装规格/净含量。
请参阅《标签标准指南》(网址:https://www.hsa.gov.sg/docs/default-source/hprg-tmhs/chpb-tmhs/tmhs_labelling_guidelines.pdf?sfvrsn=d110c43e_9)以获取更多信息。

(3)保健品声称
保健品的标签、广告或宣传不得用于任何特定的药用目的。这包括暗示治疗或预防任何疾病、病症或其相关状况的声称,更多信息请参阅HSA的《保健品声称指南》(网址:https://www.hsa.gov.sg/health-supplements/claims)。
(4)广告和促销
保健品的广告和促销无需获得许可批准,除非产品被归类为准药品(例如,仅含维生素和矿物质的产品)。如果您不确定产品的分类,请使用HSA的辅助保健品(CHP)分类工具(网址:https://www.hsa.gov.sg/CHP-classification-tool)协助您对常见辅助保健品进行分类。
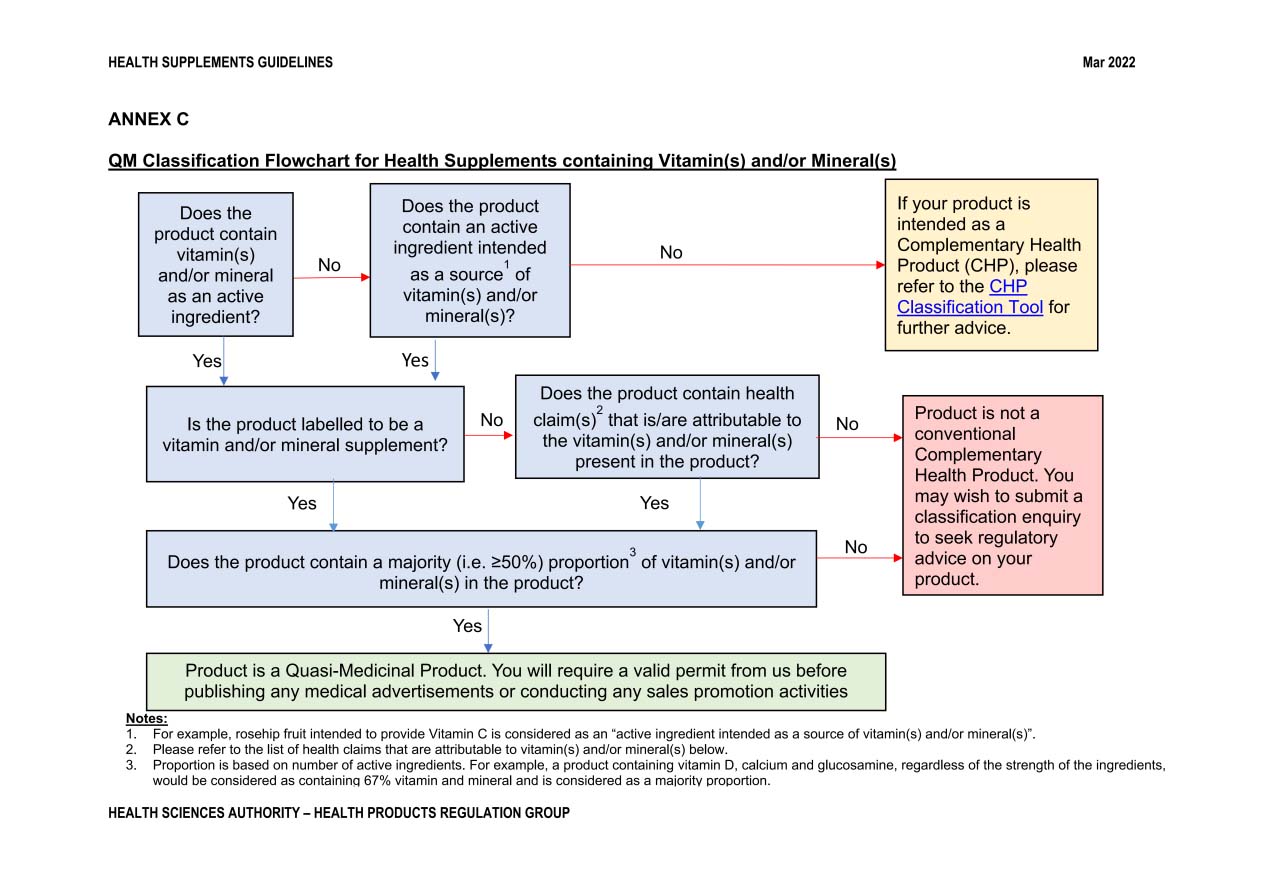
您的广告必须遵守HSA的《保健品声称指南》。广告和促销信息不得包含误导性声称、导致产品不当使用或给公众带来不当伤害。
二、传统药物监管概述
1.什么是传统药物
在新加坡的语境下,传统药物指的是马来传统药物和印度传统药物产品。它们是成品,所含成分的用途在相关传统药物文献中有记载。
食品和具有食品性质的产品属于新加坡食品局(SFA)的管辖范围。
2.对传统药物的管控
传统药物在进口、制造和销售方面,无需获得HSA的批准或牌照。HSA禁止在传统药物中添加类固醇等药用成分。HSA还对这类产品中的有毒重金属设定了严格限制。经销商(进口商、制造商、批发商和销售商)有义务确保其产品无害、安全,并且在供应传统药物到新加坡之前符合以下指南。
经销商可自愿向HSA通知其在新加坡供应的传统药物。公司必须向HSA提供相关文件,以证明其产品符合必要的安全和质量标准。
(1)安全与质量标准
作为传统药物的经销商,您必须确保您的产品符合HSA的安全与质量标准。
①禁止和受限制的成分
进口或销售的传统药物不得含有以下成分:
● 合成药物;
● 根据《毒药法令》(第234章)及其条例、《滥用药物法令》(第185章)及其条例以及《东盟传统药物成分负面清单纳入和排除指导原则》所管控和禁止的成分;
● 源自人体部位的成分;
● 可能影响人体健康的成分;
● 含有可导致动物传播疾病(如传染性海绵状脑病(TSE))媒介的成分;
● 受《濒危物种(进出口)法令》监管的成分(除非获得许可);
● 标签上未声明的活性物质。
一些物质在用于保健品和传统药物时,有可能造成不良健康影响或安全问题,因此应施加特定限制或条件(例如最大日剂量限制或标签规范)后方可使用。

②有毒重金属限值
您的产品不得超过以下重金属限值:
● 砷:5 ppm;
● 镉:0.3 ppm;
● 铅:10 ppm;
● 汞:0.5 ppm。
③微生物限值
您的产品不得超过以下微生物限值:
口服产品
● 总需氧微生物计数:每克或每毫升不超过10⁵ CFU;
● 酵母和霉菌计数:每克或每毫升不超过5 x 10² CFU;
● 大肠杆菌、沙门氏菌和金黄色葡萄球菌:1克或1毫升中不得检出。
外用产品
● 总需氧微生物计数:每克或每毫升不超过10⁴ CFU;
● 酵母和霉菌计数:每克或每毫升不超过5 x 10² CFU;
● 铜绿假单胞菌和金黄色葡萄球菌:1克或1毫升中不得检出。
尽管有上述限值规定,经销商和销售商有义务确保根据推荐的使用条件和目标用户使用时,产品的微生物含量和重金属是适宜和安全的。鼓励经销商遵守《东盟污染物限值指南》中关于微生物限值的规定。
④二甘醇和乙二醇限值
口服液体辅助保健品的二甘醇和乙二醇含量不得超过以下限值(含量(按重量计)):
● 二甘醇:1000 ppm;
● 乙二醇:1000 ppm。
⑤质量标准
您的产品需要在以下方面达到可接受的质量标准:
● 产品稳定性和保质期;
● 储存条件和分销实践;
● 生产、包装和组装条件。

(2)标签标准
您的产品标签应醒目突出。其英文信息应充分且真实。标签应包含以下内容:
产品名称(包括品牌名称,如有)
● 剂型;
● 活性成分名称和含量;
● 产品功效/预期用途;
● 用法用量;
● 批号;
● 有效期;
● 制造国;
● 本地进口商名称和地址(针对海外生产产品)或产品所有者名称和地址(针对本地生产产品);
● 禁忌症(如有);
● 其他警告(如有);
● 储存条件;
● 包装规格/净含量。
(3)传统药物声称
请注意,您亦不得声称或间接暗示产品能够预防、减轻或治愈以下任何病症:
● 失明;
● 癌症;
● 白内障;
● 药物成瘾;
● 耳聋;
● 糖尿病;
● 癫痫或惊厥;
● 高血压;
● 精神失常;
● 肾脏疾病;
● 麻风病;
● 月经不调;
● 瘫痪;
● 肺结核;
● 性功能;
● 不孕不育;
● 阳痿;
● 性冷淡;
● 受孕和妊娠。
经销商必须确保与产品相关的所有健康声称和信息均有充分依据,并按要求提交给HSA。否则,所有未经证实的健康声称和信息将被视为误导性信息,必须从产品材料中移除。请参阅《声称与声称证实指南》(https://www.hsa.gov.sg/docs/default-source/hprg-tmhs/chpb-tmhs/tmhs_claims_guidelines.pdf?sfvrsn=a9da9b67_11)以及《健康声称列表》(https://www.hsa.gov.sg/docs/default-source/hprg-tmhs/chpb-tmhs/tmhs_claims_list.pdf?sfvrsn=d4013c36_9)以获取更多信息。
(4)自由销售证书(FSC)
一些进口国可能要求提供证明,以表明产品目前在新加坡销售和分销。
因此,本地出口商可以(网址:https://form.gov.sg/67d39c40e4c978901dba350a)向HSA申请自由销售证书(FSC)。
每份自由销售证书仅针对一种产品,并可包含最多五个进口国。证书中的信息包括:
● 产品名称;
● 进口国;
● 制造商和分销商的名称和地址;
● 预期用途;
● 成分;
● 自由销售证书签发日期。
自2025年6月1日起,HSA将不再签发自由销售证书的纸质副本。取而代之的是,将通过GovTech的TrustDocs数字平台签发可验证的电子证书。这些证书的申请流程、监管要求和申请费用将保持不变。

三、新加坡保健品及传统药物自愿性产品通知
经销商可自愿向HSA通知其在新加坡供应的保健品、传统药物、药油、药膏及药贴。公司必须向HSA提供相关文件,以证明其产品符合必要的安全与质量标准。有关安全与质量标准的更多信息,请分别参阅关于保健品以及传统药物、药油、药膏和药贴的指南。只有符合安全与质量标准的产品才会在https://www.hsa.gov.sg/vns-list公布。
1.通知提交资格
您必须是已在新加坡会计与企业管理局(ACRA)注册的本地公司,才能提交产品通知。
您可以使用https://form.gov.sg/66f62f9b485a6607b3fb44e3的搜索工具,查询您产品中的成分是否列于自愿性产品通知的成分正面清单中。
正面清单中的成分可能有特定的使用条件,例如最大日剂量限制或标签规范。更多信息可查阅《保健品和传统药物中禁用和限用成分指南》(网址:https://www.hsa.gov.sg/docs/default-source/hprg-tmhs/chpb-tmhs/prohibited_restricted_ing_guidelines.pdf?sfvrsn=894959eb_4)。
2.所需文件
经销商需使用在线表格(网址:https://form.gov.sg/6746af4150d66f7a61a629b9)提交通知。
为完成通知提交,必须在通知表格中以附件形式提交以下文件:
● 制造商牌照/认证;
● 生产工艺描述;
● 成品规格;
● 分析证书(包含适当的测试参数、其规格和参考文献);
● 最终版面设计或产品标签(包括批号和有效期的位置);
● 产品说明书(如有);
● 有毒重金属和微生物限值的实验室测试报告(包含方法参考);
● 掺杂物筛查实验室测试报告(取决于产品类型);
● 起始物料中二甘醇(DEG)和乙二醇(EG)的实验室测试报告(如适用);
● 成品中二甘醇(DEG)和乙二醇(EG)的实验室测试报告(如适用);
● 传染性海绵状脑病(TSE)承诺表(如适用);
● 包装材料上标注网址或二维码的承诺表(如适用);
● 产品关联表(如适用)。
更多信息请参阅《传统药物与保健品测试要求指南》(网址:https://www.hsa.gov.sg/docs/default-source/hprg-tmhs/chpb-tmhs/tmhs_testing_guidelines.pdf?sfvrsn=92555340_9)。
注:除上述项目外,HSA可能会要求提供与您提交内容相关的其他信息。
3.产品通知费用
不收取费用。
4.如何提交通知
产品通知必须随附完整的通知表格,以及所要求的声明或证明产品符合必要安全与质量标准的文件:
提交通知前,请确保您已拥有Corppass。
使用在线表格(网址:https://form.gov.sg/6746af4150d66f7a61a629b9)提交您的通知。
如需进一步澄清,请联系HSA:HSA_CHP@hsa.gov.sg。HSA保留自行决定权,可拒绝接受具有不合规记录或正被HSA调查(因有证据表明经销商似乎未遵守HSA的监管要求)的产品的通知。若任何产品违反通知条件,HSA可将其从已通知产品列表中移除。
5.处理周期
新提交产品通知的处理周期为60个工作日,此周期不包括贵方回应HSA澄清或补充信息请求所花费的时间(公司暂停计时期间)。
6.通知流程

四、新加坡中成药监管概述
1.什么是中成药
在新加坡,中成药(CPM)指的是符合以下条件的药物产品:
● 为成品形式,例如胶囊或片剂;且
● 含有来自任何植物、动物或矿物的一种或多种活性成分,或任何来源组合,所有活性成分均须有文献记载可用于中医药用途。
以下情况不被视为中成药:
● 拟注入人体的产品;
● 含有任何化学定义的分离组分作为活性成分的产品。
2.中成药的监管要求
要在新加坡进口、批发、制造或组装中成药以供销售和供应,您需要获得产品注册批准和经销商牌照。
如果您进口中成药仅用于出口,则无需产品注册和经销商牌照,但您需要申请仅用于再出口的中成药进口许可。
(1)禁用成分
本地制造或进口销售的中成药不得含有以下物质:
● 合成药物;
● 《毒药法令》中列出的物质,但下述允许限量内的天然存在物质列表除外。
(2)天然物质的限量
中成药可在规定的可接受限度和条件下含有以下天然存在物质:
● 乌头及其生物碱:每日剂量不超过60微克;
● 苦杏仁苷:未设特定限值;
● 小檗碱、其季铵化合物及其盐:未设特定限值;
● 硼酸、硼砂:不超过5%硼酸或5%硼砂或两者组合的5%;
● 麻黄及其生物碱:少于1%;
● 半边莲及其生物碱:少于0.1%;
● 洛伐他汀:少于1%;
● 甲氧沙林:未设特定限值;
● 苯乙胺及其盐:不超过300 ppm;
● 四氢帕马丁:每日剂量不超过19毫克。

(3)标签要求
所有中成药均需有完整的英文标签。除英文外,也可使用中文或其他语言。其他语言(如适用)的信息应与已批准的英文标签内容一致。
HSA制定了一份常见中成药成分的综合双语参考列表(网址:https://www.hsa.gov.sg/docs/default-source/hprg-tmhs/chinese-proprietary-medicines/cpm_single_ing_list.pdf?sfvrsn=528b9259_1),以帮助申请者准备产品标签,特别是单方中成药制剂。
该列表包括每种成分的标准中英文名称、预期用途、剂量和注意事项说明。
内标签
● 内标签必须注明:
● 商品名或品牌名;
● 产品名称;
● 批号;
● 有效期;
● 成分名称和含量(如果内标签太小,此信息可注明在外标签上。)。
外标签
外标签必须注明:
● 商品名或品牌名;
● 产品名称;
● 批号;
● 有效期;
● 进口商、批发商、制造商和组装商(如有)的名称和地址;
● “Allowed for sale as a Chinese Proprietary Medicine based on information submitted to the Authority. Consumer discretion is advised. 根据向当局提呈的资料允许作为中成药销售。谨慎选用。”:
○ 文字必须清晰易读,并以不可磨灭的方式印制;
○ 英文字体高度不应小于1.5毫米,中文字体高度不应小于2毫米;
○ 文字必须置于方框区域内且清晰可见,此方框区域内不得出现任何其他内容;
○ 标签必须在显著位置醒目显示。
注:如无外标签,则上述信息必须注明在内标签上。
说明书
说明书必须注明:
● 商品名或品牌名;
● 产品名称;
● 制造商名称和地址;
● 成分名称和含量;
● 剂量、适应症、禁忌症和副作用;
● 给药频率和方法。
注:如无说明书,则上述信息必须注明在内标签或外标签上。

电子标签(E-labelling)指南
电子标签指通过电子方式分发的产品信息,例如通过产品包装上的机器可读码(如二维码)或网址链接到数字格式的产品信息。目前,中成药的电子标签仅适用于产品说明书。
有意为其产品使用电子标签的经销商须告知HSA。
禁止声称的疾病和病症
您不得声称或间接暗示产品能够预防、减轻或治愈以下19种疾病和病症:
● 失明;
● 癌症;
● 白内障;
● 药物成瘾;
● 耳聋;
● 糖尿病;
● 癫痫或惊厥;
● 高血压;
● 精神失常;
● 肾脏疾病;
● 麻风病;
● 月经不调;
● 瘫痪;
● 肺结核;
● 性功能;
● 不孕不育;
● 阳痿;
● 性冷淡;
● 受孕和妊娠。
(4)有毒重金属限值
您的产品不得超过以下重金属限值:
● 砷:5 ppm;
● 镉:0.3 ppm;
● 铅:10 ppm;
● 汞:0.5 ppm。
经销商可参考以下建议控制其产品的重金属含量:
● 识别可能导致产品中重金属含量较高的起始物料(例如某些草药、矿物);
● 采购经测试证实重金属含量低于规定限值的起始物料;
● 确保草药原料在使用前不含土壤颗粒(例如,如适用,进行彻底清洗);
● 如有必要,在生产流程中纳入相关提取工艺以去除产品中的重金属。

(5)微生物限值
中成药必须经过测试,符合以下微生物计数标准:
口服中成药
● 总需氧微生物计数:每克或每毫升不超过10⁵ CFU;
● 酵母和霉菌计数:每克或每毫升不超过5 x 10² CFU;
● 大肠杆菌、沙门氏菌和金黄色葡萄球菌:1克或1毫升中不得检出。
外用中成药
● 总需氧微生物计数:每克或每毫升不超过10⁴ CFU;
● 酵母和霉菌计数:每克或每毫升不超过5 x 10² CFU;
● 铜绿假单胞菌和金黄色葡萄球菌:1克或1毫升中不得检出。
(6)二甘醇和乙二醇限值
口服液体辅助保健品的二甘醇和乙二醇含量不得超过以下限值(含量(按重量计)):
● 二甘醇:1000 ppm;
● 乙二醇:1000 ppm。
(7)传染性海绵状脑病
动物源性成分
传染性海绵状脑病(TSE)指一组进行性疾病,包括绵羊和山羊的痒病、骡、鹿和麋鹿的慢性消耗病、牛的牛海绵状脑病 (BSE),以及人类的库鲁病和克雅氏病 (CJD)。
引起这些疾病的感染因子会复制并导致神经系统疾病,最终导致感染者死亡。目前尚无针对这些疾病的早期诊断测试或已知疗法。
如果您的产品含有动物源性成分,您必须遵守HSA的TSE指南(网址:https://www.hsa.gov.sg/docs/default-source/hprg-tmhs/tse-guidelines.pdf?sfvrsn=8b87c50e_5),以最大程度降低TSE传播风险。
(8)濒危物种物质
如果您的产品含有《濒危物种(进出口)法令》所列濒危物种的物质,您应联系国家公园局的野生动物管理组,以获取必要的《濒危野生动植物种国际贸易公约》(CITES)进出口许可。

3.在新加坡申请中成药新产品注册
在新加坡进口、制造或组装您的中成药之前,您必须首先申请产品注册。如果您打算申请《中成药出口商证书》(自由销售证书)以促进中成药产品出口新加坡,您也需要进行产品注册。
对于仅用于再出口而进口的中成药,则不需要产品注册。但需要申请中成药再出口进口许可。
(1)申请资格
您必须是已在ACRA注册的本地公司,才能提交新产品注册申请。作为中成药产品注册的申请人,您将被视为该产品的负责人。
(2)所需文件
①进口产品
● 符合标签要求、拟在新加坡销售/供应的产品标签,包括:
○ 内标签;
○ 外标签或外盒(如有);
○ 说明书(如有);
● 在制造国销售或供应的产品标签,包括:
○ 内标签;
○ 外标签或外盒(如有);
○ 说明书(如有);
● 产品内容物照片,仅在要求时才需提交产品实物样品;
● 制造商牌照或证书;
● 良好生产规范(GMP)证书(如有);
● 产品注册证书,如无法提供,则需提供有效的《中成药出口商证书》(自由销售证书)、药品产品证书(CPP)或类似文件;
● 有毒重金属和微生物限值的测试结果;
● 二甘醇和乙二醇的测试结果:适用于含有甘油、丙二醇或山梨醇溶液的口服液产品;
● 生产工艺描述;
● 中成药产品的一般质量参数信息,包括:
○ 储存条件;
○ 产品的物理特性,如颜色、味道、气味、形状、胶囊尺寸等,可包含在产品分析证书中或作为单独文件;
○ 产品的物理规格,可包含在产品分析证书中或作为单独文件;
● 成品规格;
● 由海外制造商确认的产品配方(包括所有活性及非活性成分);
● 海外制造商承诺书,承诺产品不含任何西药或活性合成物质;
● 产品在销售国家/地区的法定分类信息;
● 网站承诺书(适用于标签上注明网站的产品);
● 传染性海绵状脑病(TSE)承诺书(适用于含有反刍动物来源材料的产品,包括用于制作胶囊壳的材料,例如牛、水牛、绵羊、山羊、鹿、羚羊);
● 发酵物质所需信息(适用于含有发酵物质的产品,例如冬虫夏草、红曲米)。
请确保您提交的文件由正确的签署人签署:
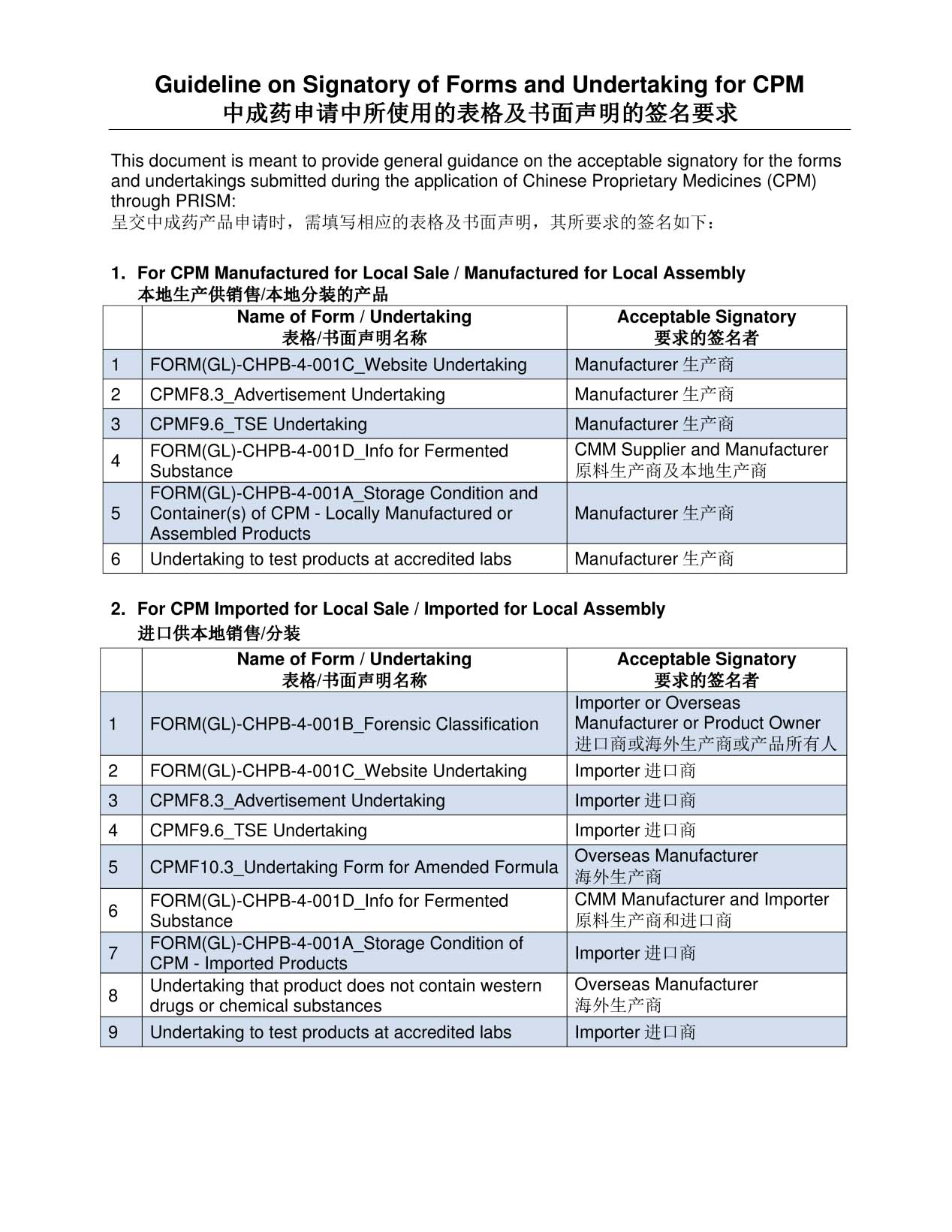
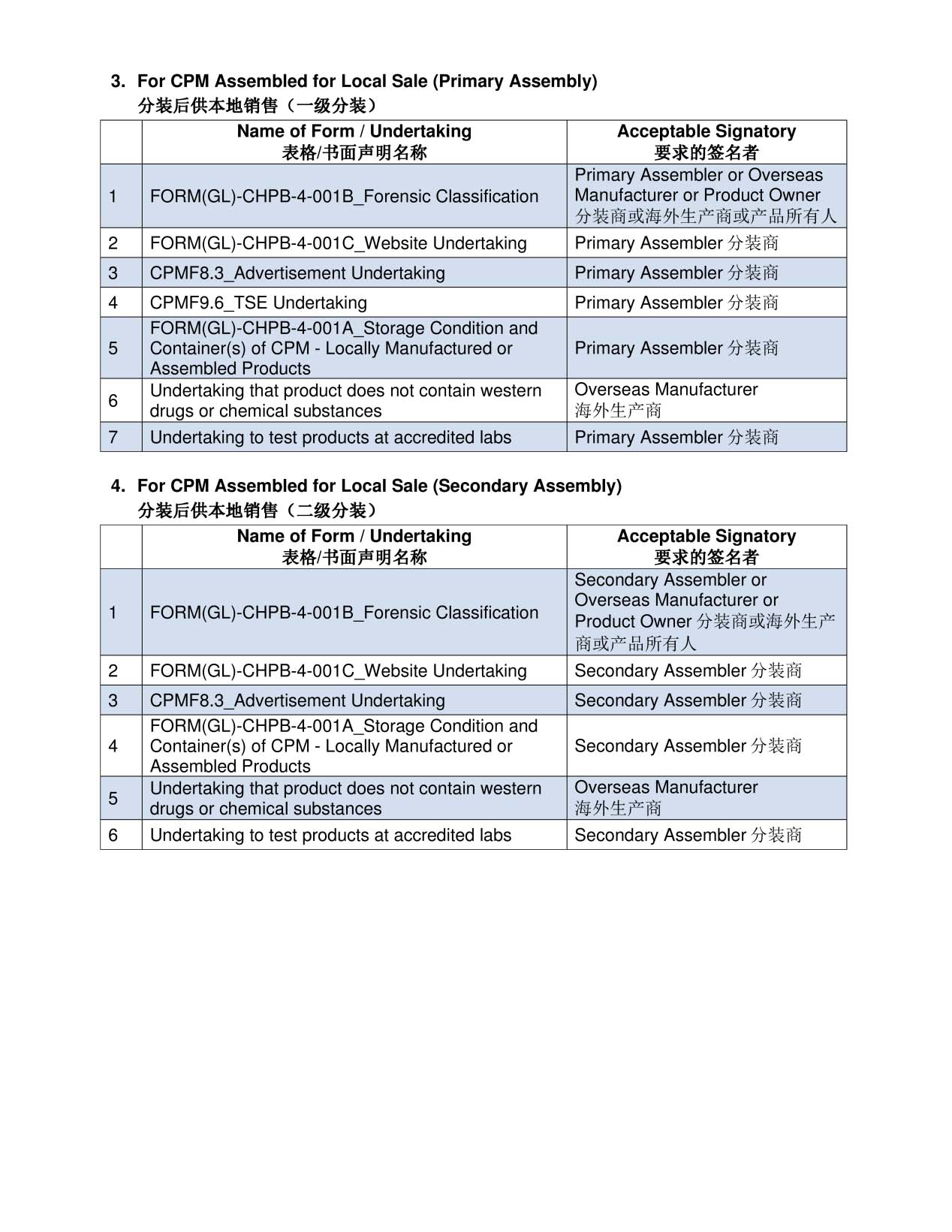
注:除上述项目外,HSA可能会要求提供与您申请相关的其他信息。
如果您是首次提交中成药产品注册申请,建议您通过电子邮件联系HSA安排提交前咨询。
②本地生产产品
● 符合标签要求、拟在新加坡销售/供应的产品标签,包括:
○ 内标签;
○ 外标签或外盒(如有);
○ 说明书(如有);
● 产品内容物照片,仅在要求时才需提交产品实物样品;
● 有毒重金属和微生物限值的测试结果;
● 二甘醇和乙二醇的测试结果:适用于含有甘油、丙二醇或山梨醇溶液的口服液产品;
● 生产工艺描述;
● 中成药产品的一般质量参数信息,包括:
○ 储存条件;
○ 产品的物理特性,如颜色、味道、气味、形状、胶囊尺寸等,可包含在产品分析证书中或作为单独文件;
○ 产品的物理规格,可包含在产品分析证书中或作为单独文件;
● 成品规格;
● 网站承诺书(适用于标签上注明网站的产品);
● 传染性海绵状脑病(TSE)承诺书(适用于含有反刍动物来源材料的产品,包括用于制作胶囊壳的材料,例如牛、水牛、绵羊、山羊、鹿、羚羊);
● 发酵物质所需信息(适用于含有发酵物质的产品,例如冬虫夏草、红曲米)。
确保您提交的文件由正确的签署人签署。
注:除上述项目外,HSA可能会要求提供与您申请相关的其他信息。
如果您是首次提交中成药产品注册申请,建议您通过电子邮件联系HSA安排提交前咨询。

(3)产品注册费用
不收取费用。
(4)如何申请
通过PRISM系统提交申请。访问该电子服务前,请确保您已具备:
● CRIS公司账户;
● Corppass或HSA PIN。
如果遇到技术问题,请发送电子邮件至HSA帮助台或致电6776 0168(每日上午7:00至午夜)。
4.中成药进口商、批发商和制造商牌照
(1)进口与批发经销商牌照
申请提交
对于进口牌照,您需要在申请中成药进口牌照之前,至少已获得中成药产品注册申请的原则性批准。中成药进口牌照的颁发,取决于中成药产品注册的批准以及良好分销规范审计的满意结案。
仅为了再出口至其他国家而进口中成药的公司不需要申请进口牌照。但您需要申请中成药再出口进口许可。
所需文件
您需要提交以下文件:
● 场所的当前布局平面图,需标明存储区域,布局平面图需要包含以下信息:
(i)仓库的完整地址;
(ii)仓库的尺寸(长和宽);
(iii)标明各类存储区域,例如:收货区、待验产品区、合格产品区、不合格产品区、退回产品区、召回产品区、发货暂存区等;
● 良好分销规范标准操作程序;
● 良好分销规范记录或记录模板;
● 外包活动与合约接受方签订的合同,其中需明确规定各方的角色和责任(如适用)。
良好分销规范审计
所有中成药进口商和批发商都必须强制遵守良好分销规范(GDP)标准,网址:https://www.hsa.gov.sg/chinese-proprietary-medicines/dealers-licence/gmp-gdp-standards。
收到您的牌照申请后,HSA将通知您对您的场所进行GDP审计的日期。
只有在审计结案之日起10个工作日后,并且确认贵公司符合要求的GDP标准,牌照才会被批准和颁发。
牌照批准后,将进行定期的常规审计,以评估贵公司是否持续合规。常规审计的频率取决于风险因素,如贵公司开展的活动以及您对监管要求的合规水平。也可能进行突击审计。
如何申请
通过PRISM系统提交申请。访问该电子服务前,请确保您已具备:
● CRIS公司账户;
● Corppass或HSA PIN。
如果遇到技术问题,请发送电子邮件至HSA帮助台或致电6776 0168(每日上午7:00至午夜)。

(2)制造商牌照
申请提交
所需文件
您需要提交以下文件:
● 场地主文件:
○ 此为强制性要求,文件的扫描件可作为附件随申请提交;
○ 场地主文件应根据PIC/S《药品制造商场地主文件编写解释性说明》(网址:https://www.picscheme.org/layout/document.php?id=129)进行编制;
● 合约测试实验室的认证证书(如有);
● 批准该场所用于生产和储存健康产品的机构所颁发的许可批准函(如适用);
● 所制造和组装剂型及产品的详细信息:
○ 请注明贵公司是否为这些产品充当合约接受方(即为他人部分或全部生产);
良好生产规范审计
所有中成药产品制造商(包括组装商)都必须强制遵守良好生产规范(GMP)标准,网址:https://www.hsa.gov.sg/chinese-proprietary-medicines/dealers-licence/gmp-gdp-standards。
收到您的牌照申请后,HSA将联系贵公司安排批准前审计。将发送审计前通知信,告知GMP审计日期。
您的场地主文件(SMF)应根据PIC/S出版物网站(网址:https://picscheme.org/en/publications?tri=all)上提供的《药品制造商场地主文件(SMF)编写解释性说明》进行编制。您的SMF需要包含以下主题:
● 基本信息;
● 药品质量体系;
● 人员;
● 厂房与设备;
● 文件管理;
● 生产;
● 质量控制;
● 外包活动;
● 投诉与产品召回;
● 自检。
只有在审计结案之日起10个工作日后,并且确认贵公司符合要求的GMP标准,制造商牌照才会被颁发。
牌照批准后,将进行定期的常规审计,以评估贵公司是否持续合规。常规审计的频率取决于风险因素,如贵公司开展的活动以及您对监管要求的合规水平。也可能进行突击审计。
如何申请
通过PRISM系统提交申请。访问该电子服务前,请确保您已具备:
● CRIS公司账户;
● Corppass或HSA PIN。
如果遇到技术问题,请发送电子邮件至HSA帮助台或致电6776 0168(每日上午7:00至午夜)。

5.中成药进口再出口许可
您需要申请中成药进口再出口许可。
如果您进口中成药仅用于再出口至其他国家,且进口的中成药不供应给新加坡市场,则可能豁免产品注册和经销商牌照要求。
申请要求
经销商必须在进口前至少一周,申请仅用于再出口目的的中成药产品进口许可。您需要在在线表格中提交以下信息:
● 公司详情;
● 申请人详情;
● 中成药产品详情。
同时,您必须确保:
● 中成药产品需在进口之日起一年内,以其原始包装直接、完全地再出口;
● 确保在再出口后7天内,附上证明文件通知HSA;
● 中成药产品不得在新加坡销售、供应或处置;
● 相关记录自最后一笔交易之日起保存2年。
所需文件
以下支持性文件需扫描或随申请附上:
● 产品配方(所有产品均需附上);
● 货物发票。
如何申请
通过PRISM系统提交申请。访问该电子服务前,请确保您已具备:
CRIS公司账户;
Corppass或HSA PIN。
如果遇到技术问题,请发送电子邮件至HSA帮助台或致电6776 0168(每日上午7:00至午夜)。
如果您需要在新加坡进行医疗器械注册或医疗相关牌照的申请,欢迎扫描下方二维码咨询金阁顿专业顾问。金阁顿官方合作伙伴(包括合资公司)在新加坡、印度尼西亚及马来西亚依法持有相关医疗牌照与资质,可协助医疗器械及医药品牌出海,以推进国际市场布局。
此外,金阁顿可为您提供一站式专业服务,全面支持医疗器械与医药品牌出海的全流程需求。

金阁顿(GolddenGroup)成立于花园城市新加坡,专业服务高净值家族和专业金融机构。主打业务有新加坡家族办公室/家族基金设立,私募基金(VCC及子基金)备案,PPLI,境外资产管理,新加坡移民,和境外保单,是您新加坡一站式的家族管家。金阁顿,为您的下一代继续服务。

·新加坡最富裕20%家庭平均净资产530万新元 财富基尼系数为0.55
·【新加坡药品类牌照】(三)保健品、传统药物、中成药监管及中成药进口商、批发商和制
